beat365雷曉光課題組與合作者-北京生命科學研究所董夢秋課題組近期在《Nature Communications》雜志上發表論文,開發出新型精氨酸選擇性化學交聯劑ArGO和精氨酸/賴氨酸雙選擇性化學交聯劑KArGO,并且證明該類新型化學交聯劑可以極大推動化學交聯質譜技術發展,幫助闡明複雜蛋白質結構和發現新的蛋白質相互作用。文章題目為:“Improving mass spectrometry analysis of protein structures with arginine-selective chemical cross-linkers”。
化學交聯結合質譜技術 (chemical cross-linking coupled with mass spectrometry, CXMS) 是近年來迅猛發展的一種檢測蛋白質結構和蛋白質相互作用的方法。随着質譜儀器以及交聯數據搜索軟件的發展,CXMS技術已經獲得了長足的進步,但在該技術中能夠應用的交聯劑類型卻并不豐富。目前商業可購買的交聯劑主要是針對蛋白質N端和賴氨酸殘基,還有少量針對半胱氨酸殘基。精氨酸在蛋白質中含量豐富 (>5%),而且經常出現在蛋白質相互作用界面中。但目前還沒有成熟的針對精氨酸殘基選擇性的交聯劑被開發出來。
為了進一步豐富交聯劑的種類,雷曉光課題組與董夢秋課題組合作開發了靶向精氨酸的交聯劑。該系列交聯劑在不同長度的聚乙二醇單元兩端連接芳基取代甲酰甲醛結構(aromatic glyoxal),分别命名為ArGO1-3交聯劑。此外根據甲酰甲醛結構的相對位置、苯基取代情況、交聯劑臂長情況以及化學連接方式的情況,還開發出meta-ArGO1-2、ortho-ArGO1、MeO-ArGO1-2、HP-ARGO1以及amide-ArGO1-2等一系列ArGO交聯劑。
ArGO交聯劑可以共價連接蛋白質表面兩個精氨酸殘基。該反應具有良好的化學選擇性,交聯位點具有廣泛的互補性(圖1)。

圖1 ArGO與精氨酸反應
除此之外,雷曉光課題組還将ArGO交聯劑進行結構拓展,将交聯劑一端換為靶向賴氨酸殘基的鄰苯二甲醛結構,并将其命名為KArGO交聯劑。KArGO交聯劑可以共價連接蛋白質表面精氨酸殘基和賴氨酸殘基,進一步增加了交聯位點可能性,提高了交聯肽段的結構覆蓋度,并在多樣品測試中表現出穩定可靠的交聯效果(圖2)。
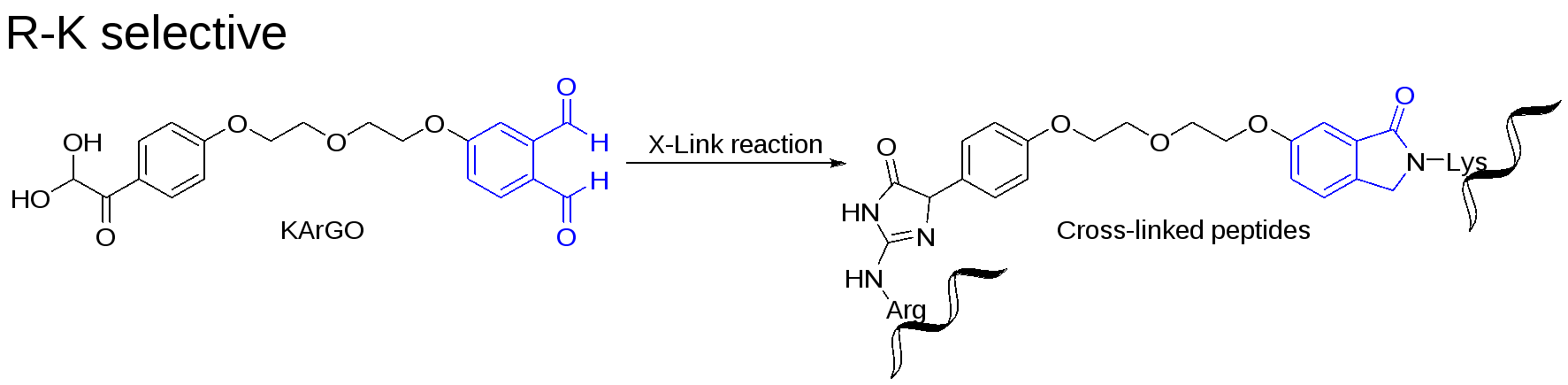
圖2 KArGO與精氨酸、賴氨酸反應
董夢秋課題組将ArGO和KArGO交聯劑運用到CNGP和UtpA等蛋白質複合物的結構鑒定中。增加了ArGO和KArGO交聯劑的特異性交聯位點信息後,模拟的蛋白質結構與晶體結構吻合度更好。此結果表明ArGO和KArGO交聯劑彌補了已有賴氨酸交聯劑的不足,提供了豐富的互補結構信息(圖3)。該工作所開發出的新型交聯劑即将由百靈威科技有限公司進行商業化推廣,從而幫助進一步推進CXMS技術在分析複雜蛋白質結構和發現新型蛋白質相關作用研究中的廣泛應用。


圖3 CNGP蛋白複合物Rosetta模拟結構展示
雷曉光課題組英國籍博士後Alexander X. Jones博士以及博士生唐毓良,董夢秋課題組博士生曹勇作為該文章的共同第一作者。文章的通訊作者是雷曉光博士和董夢秋博士。該工作還得到了中科院計算所賀思敏課題組,北京生命科學研究所邵峰課題組、黃牛課題組,以及中科院生物物理所葉克窮課題組的幫助。上述研究得到了科技部-國家重點研發計劃-蛋白質機器與生命調控專項、973計劃、國家自然科學基金委(傑青、重點、面上、創新群體項目)、北大-清華生命科學聯合中心基金、中科院和北京市政府的資助,在beat365和北京生命科學研究所完成。